

BioWhittaker™ 専門培地
TheraPEAK® X-VIVO™ 無血清リンパ球培地
Serum-free, GMP produced medium for cell therapy applications
X-VIVO™ 無血清リンパ球培地が細胞治療 製造用培地として本格登場
X-VIVO™ 無血清リンパ球培地は、T細胞・NK細胞・樹状細胞・CD34+細胞・PBMCなどの免疫細胞の培養に適切かつバランスの取れた環境を与える高機能の培地シリーズです。X-VIVO™ 培地は科学論文に幅広く引用されており、世界中の多くの細胞治療アプリケーション(開発段階から臨床試験段階、薬事承認済と様々なステージ)において、製品の高い信頼性が証明されています。X-VIVO™ 培地シリーズのご利用により、多くの示唆に富んだ細胞治療の成功例が生み出されることでしょう。
X-VIVO™ 3タイプにおける主な細胞培養実績
- X-VIVO™ 10 LAK細胞
- X-VIVO™ 15 T細胞、樹状細胞、NK細胞、CD34+造血幹細胞
- X-VIVO™ 20 PBMC
X-VIVO™ 無血清リンパ球培地は、お客様の研究・開発ステージに応じて2つのグレードを用意しています。
研究グレード(Research Use Only)
X-VIVO™ 無血清リンパ球培地 
製造グレード(For Further Manufacturing)
TheraPEAK® X-VIVO™ 無血清リンパ球培地 
X-VIVO™ 無血清リンパ球培地 研究グレード (Research Use Only)
X-VIVO™ 無血清リンパ球は、T細胞、樹状細胞、NK細胞、CD34+造血幹細胞などのリンホカイン活性化キラー(LAK)細胞、末梢血リンパ球(PBL)、腫瘍浸潤性リンパ球(TIL)などの種々の細胞に栄 養学的に完全でバランスのとれた環境を提供します。培地には、外因性成長因子、細胞を増殖させるための人工刺激物質、未知の添加物は含まれません。培地にはプロテインキナーゼ C 刺激物質が含まれていないため、ヒトやネズミのリンパ球を活性化させるセカンドメッセンジャー系の研究に適しています。完全培地なので製薬レベルのヒトア ルブミン、組換え型ヒトインスリン、低温殺菌処理を施したヒトトランスフェリンが含まれます。
X-VIVO™ 10 無血清リンパ球培地
無血清環境下での LAK 細胞の生成を促すことを目的としています。従来のプロトコルでは、rIL-2/ml が1,000セタス存在下、濃度1.0~3.0×106 細胞/ml で、患者または正常なドナーの PBLを3日間培養されていました。X-VIVO™ 10培地では、最適なLAK 細胞の生成が rIL-2が100~1,000セタス存在下で PBL を3~10日間、1.0~6.0×106 細胞/ml の密度で培養によって実現します。
X-VIVO™ 15 無血清リンパ球培地
X-VIVO™ 15培地は、組成上 X-VIVO™ 10培地に類似していますが、無血清条件下でTILの増殖用に最適化されています。X-VIVO™ 15培地は、末梢血およびヒトの腫瘍から単離された精製 CD3+ 細胞の増殖を促します。X-VIVO™ 15培地は、ヒト単球、マクロファージ細胞、細胞株、PBL、顆粒球、ナチュラルキラー(NK)細胞の成長促進にも使用可能です。加えて、HUT-78や 関連のヒトリンパ球細胞株の無血清状態での増殖を促します。
X-VIVO™ 15を用いたアプリケーション例
PBMCを利用したT細胞の増殖アッセイ
NK細胞拡大培養・活性化および細胞障害性アッセイ
Matched PBMCによる樹状細胞およびT細胞アッセイ
X-VIVO™ 20 無血清リンパ球培地
X-VIVO™ 20培地は、高密度で、単球除去 PBL 由来の LAK 細胞の生成を促すよう最適化されています。初期細胞密度2.0~3.0×107細胞/ml で、LAK 細胞を生成できます。X-VIVO™ 20培地も、PBLやTILの増殖培地として使用することも可能です。
TheraPEAK® X-VIVO™ 無血清リンパ球培地 製造グレード (For Further Manufacturing)
特長・利点
- 無血清培地による安定した品質
- GMPガイドラインに基づいた製造管理
- X-VIVO™ 10, 15の異なる成分組成により、目的に応じた使い分けが可能
- スケールアップを視野にいれたカスタム包装も可能
- 必要なサイトカインを添加するだけの簡便な製品フォーマット
GMP品質
臨床プロセスにおける信頼のおける結果、最終的には患者の安全のため、製品の高い品質や安全性は絶対に欠かすことのできない要素です。ロンザは、高品質の細胞・遺伝子治療関連製品としてTheraPEAK® 製品ラインを世界中の顧客に供給してまいりました。TheraPEAK® X-VIVO™ 培地は21 CFR Part 820(医療機器に関する米国レギュレーション)に準拠して製造されています。またロンザの製造サイトは、ISO13485認証に基づく品質マネジメントシステムを保有する企業として米国FDA登録がなされています。GMP品質を有する製造用途のTheraPEAK® X-VIVO™ 培地は、ゲンタマイシンやフェノールレッドは含まれていません。
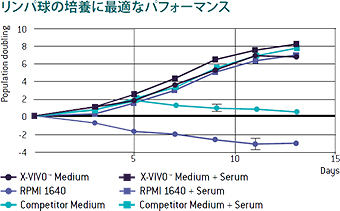
初代ヒトCD4およびCD8+ T細胞を1:1の割合で混合し、CD3/CD28磁気ビーズで活性化後、 X-VIVO™ 15 無血清リンパ球培地、RPMIおよび他社培地で、それぞれ無血清(●)および血清添加(■)の条件で培養を行いました。
本データは以下より引用しました:Medvec R. et al. Improved Expansion and In Vivo Function of Patient T Cells by a Serum-Free Medium. Molecular Therapy: Methods & Clinical Development. Volume 8, P65-74. March 2018. https://doi.org/10.1016/j.omtm.2017.11.001, CC BY 4.0.
TheraPEAK® X-VIVO™ は、研究用培地と比較して高い製造および品質管理基準を有する培地製品として販売しています。しかしながら当該培地製品を再生医療等製品 製造用途にご使用するにあたっては、お客様自らのバリデーションを実施して頂き、規制当局と薬事相談を行った上で、お客様の責任の下でご使用に関する判断を行って下さい。
 MODAソシューション
MODAソシューション 細胞/培地
細胞/培地 遺伝子導入
遺伝子導入 バイオアッセイ・
バイオアッセイ・ エンドトキシン
エンドトキシン 関連情報(Tech Tip)
関連情報(Tech Tip) 手順説明動画
手順説明動画 Webinar Archive
Webinar Archive よくあるご質問(FAQ)
よくあるご質問(FAQ) CoA / 試験成績書
CoA / 試験成績書 CoA / 試験成績書
CoA / 試験成績書 Safety Data Sheet(SDS)
Safety Data Sheet(SDS)
